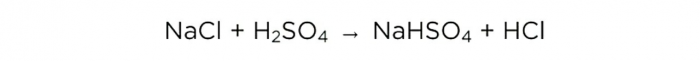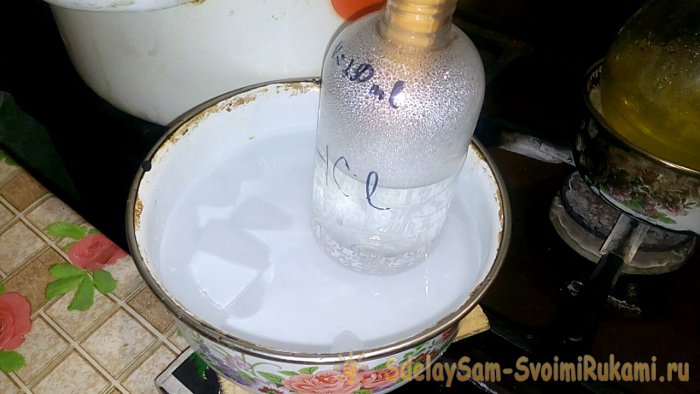Алхимики, впервые получившие соляную кислоту в 15 веке, назвали её «spiritus salis», «дух из соли». Эта кислота обладала на тот момент волшебными свойствами: разъедала бумагу, растворяла металлы, отравляла людей. Эти свойства остались у неё и по сей день, но сейчас эта кислота достаточно изучена, и волшебства здесь нет.
Соляная кислота (HCl) - сильная одноосновная кислота, в чистом виде - прозрачная жидкость. При своей максимальной концентрации 38% «дымит» на воздухе. Мы же будем получать кислоту с концентрацией вдвое меньшей.
Итак, приступим.
Техника безопасности
Осторожно, работа с ядовитыми веществами!
Все опыты необходимо проводить в хорошо вентилируемом помещении либо под вытяжкой, Обязательно в защитных очках (можно приобрести в строй. магазине) и перчатках (если не найдёте специальные химические перчатки, подойдут хорошего качества для мытья посуды).
На месте проведения опыта обязательно должна присутствовать пищевая сода, чтобы в непредвиденной ситуации нейтрализовать ею кислоту (при этом выделится углекислый газ и вода).
Строго запрещено проводить эксперимент в металлической посуде.
Понадобится
Для проведения опыта нам потребуется:
- Кислотный электролит для аккумуляторов (продаётся в автомагазине);
- Дистиллированная вода (там же);
- Поваренная соль (есть на любой кухне);
- Пищевая сода (см. технику безопасности).
Из посуды необходимо:
- Стеклянная колба;
- Сосуд с песком, куда можно колбу поместить;
- Несколько одноразовых стаканчиков 200 мл;
Если Вы располагаете термостойкой колбой, то можно нагревать её под открытым пламенем горелки. Но всё же рекомендую через песок, в случае чего он впитает в себя кислоту.
Также понадобятся пара сантехнических уголков диаметром 50 мм и горелка (в моём случае спиртовая, но рекомендую использовать газовую).
1 этап - выпаривание
Электролит для аккумуляторов - самая что ни на есть 36%-ая серная кислота (H2SO4). Вначале нам необходимо повысить её концентрацию.
Наливаем в стаканчик 200 мл, то есть почти до краёв и переливаем чуть больше половины стаканчика в колбу. Делаем маркером метку и доливаем остальное.
Поставил вокруг колбы отражатель из фольги для более эффективного нагревания, но позже снял, ибо начал плавиться.
Теперь ставим колбу на горелку и выпариваем до уровня поставленной ранее метки, даже чуть ниже.
Параллельно надеваем на уголок сложенную в несколько раз марлю и фиксируем резинкой. Готовим ненасыщенный раствор соды и макаем в него конец уголка с марлей.
Когда электролит начнёт кипеть, надеваем на колбу уголок, он плотно на неё садится. Марлевый конец направляем в открытое окно.
Это необходимо, если вдруг вместе с водой начнёт испаряться сама серная кислота. Если сильно не перегревать колбу, этого не произойдёт.
Горелка в действии:
Мощность моей горелки сравнительно мала, поэтому выпаривание заняло около часа. Газовая горелка или электрическая плита значительно бы ускорили этот процесс.
После завершения первого этапа в колбе должно остаться чуть меньше половины раствора, то есть кислота концентрацией около 75%. Не забываем про аккуратность.
Даём ей остыть до комнатной температуры.
2 этап - вычисления
Теперь, когда у нас есть концентрированная серная кислота, можем провести основную реакцию, она выглядит следующим образом:
Но прежде давайте проведём некоторые вычисления, а в конце сравним их с тем, что получилось на практике.
Итак, изначально у нас было 200ml электролита плотностью 1,27 г/см³. Заглянув в таблицу плотностей серной кислоты увидим, что данная плотность соответствует концентрации 36%. Вычислим объём кислоты:
200ml*36%=72ml - V(H2SO4)
После того, как мы выпарили раствор, его концентрация, а соответственно, и плотность увеличилась. Глядим в ту же таблицу и видим, что концентрации 75% соответствует плотность 1,67 г/см³.
Зная текущую плотность(p) и объём(V) кислоты узнаем массу:
m=p*V;
m(H2SO4)=1,67г/см³ * 72ml=120г;
m(H2SO4)=1,67г/см³ * 72ml=120г;
Теперь из школьной химии вспоминаем:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
где M - молярная масса вещества.
где M - молярная масса вещества.
Молярные массы H2SO4, NaCl и HCl соответственно равны 98, 58.5 и 36.5 г/моль. Теперь мы можем узнать, сколько понадобится поваренной соли и сколько получится HCl.
А именно нам понадобится 72г NaCl, это 34 мл, возьмём в избытке - четверть стаканчика.
Отлично, а HCl в теории выйдет 44,7г.
В таблице плотностей HCl есть столбец г/л. Берём оттуда значение для концентрации 15% - 166,4 г/л. Объём воды, необходимый для получения 15% HCl равен 44,7/166,4≈270ml. Мы возьмём 200ml. В итоге в теории у меня выйдет 22%-ная соляная кислота.
3 этап - получение кислоты
Соединяем два уголка следующим образом:
А вся конструкция будет выглядеть так:
В сосуд с надписью HCl будет конденсироваться соответствующая кислота, объём воды в нём - 200ml. Также на этом сосуде отметьте текущий уровень жидкости.
Снимаем уголки и через воронку засыпаем в колбу вычисленное в расчётах количество соли.
Раствор желтеет.
Чтобы соляная кислота начала выделяться, необходимо включить горелку. Но вначале плотно присоединяем к колбе и получающему сосуду уголки.
При конденсации кислоты в воде, образуются “вертикальные волны”. Также при этом раствор нагревается, и его надо охлаждать. Например, можно снизу поставить ещё один сосуд со льдом.
Реакция протекает относительно быстро - 20 минут, после чего можно выключать огонь. Даём последним парам соляной кислоты раствориться в воде, после чего герметично закрываем сосуд. Когда колба остынет, разбавляем оставшийся там раствор водой (примерно один к одному) и сливаем его в канализацию.
Итог
По метке на сосуде определяем, сколько жидкости прибавилось. У меня это ⅙, то есть 17%. Это и есть концентрация нашей соляной кислоты. Сравним её с той, которая получается в теории.
17%/22%*100%=77% - выход реакции.
Важно отметить, выхода равного 1 не бывает, всегда есть потери. В моём случае это недостаточно выпаренный электролит. В идеале концентрация серной кислоты должна быть 90-95%.
Проверим получившуюся кислоту на взаимодействие с металлом.
Наблюдаем бурное выделение водорода. Это означает, что кислота пригодна для дальнейших экспериментов.
Вариации
В качестве колбы можно воспользоваться чистой стеклянной бутылкой из-под пива или газировки, но при условии, что нагревание будет максимально плавным. Вместо ПВХ уголков можно взять полипропиленовые трубы и уголки меньшего диаметра (подходящего под Вашу колбу).
Ещё раз призываю соблюдать технику безопасности. Всем удачных опытов!